|
|
 I Présentation des pluies acides
--- --- --- --- --- --- --- --- ---
A. Définition - B. Formation - C. origine
--- --- --- --- --- --- --- --- --- --- --- ---
B). Formation des composés acides
Ces gaz atmosphériques vont subir des transformations
qui font partie de leur cycle biogéochimique naturel : A partir des oxydes de souffre :
SO2 Au contact de la vapeur d’eau
atmosphérique, il se forme l’acide sulfureux :
SO2
+ H2O = H2SO3 Après un certain temps passé dans l’atmosphère
sous cette forme, l’acide sulfureux, produit instable, va se transformer en
acide sulfurique :
2 H2SO3
+ O2 = 2 H2SO4 C’est la dissolution de celui-ci qui
va donner son acidité à la solution : H2SO4 = SO42- + H+
A partir des oxydes d’azote : NOX Le monoxyde d’azote (mais aussi le
protoxyde d’azote N2O), instable, va être oxydé par le dioxygène
atmosphérique : NO + ½ O2 = NO2 Puis, au contact de l’eau va se former
l’acide nitrique : NO2 + H2O = HNO-3 + H+ A partir du dioxyde de carbone : CO2 + H2O = HCO-3
+ H+ D’un point de
vue physico-chimique, la transformation de ces composés entraîne
systématiquement la libération de protons H+ ou d’ions H3O+.
Ce sont eux qui sont en fait responsable de l’acidité finale de la solution. En
effet, la loi de Brönsted sur l’équilibre des réactions acido-basiques nous
donne l’équilibre suivant :
pH = -Log
[H3O+] Cette relation suppose que plus la concentration en protons H+ ou en ions H3O+ est élevée, et plus la solution est acide. C’est donc la réaction des acides sulfuriques, nitriques, et carboniques, qui confère aux précipitations leur pH bas, et donc leur acidité. Maintenant que nous avons clairement identifié les composés impliqués dans la formation des pluies acides, et définis les mécanismes de la formation de celles-ci, nous allons nous intéresser à la cause de l’arrivée de ces composés dans l’atmosphère. 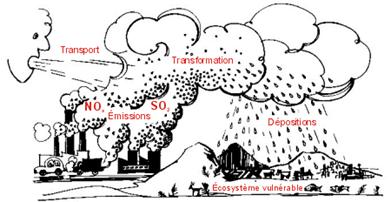 Affichage optimisé 800x600 & 1024x768. Site testé sous Internet Explorer 6, Mozilla et Konqueror. TPE L'araignée et sa toile - 2004 |